開篇宣告:1:以下內容轉自以下內容轉自微信公眾號凱諾醫藥《【技術】非盲態下的樣本量重估》,如有侵權,可聯絡刪除
2. 以下觀點,僅代表作者個人觀點,請帶著質疑的態度去閱讀。如有問題,歡迎評論區留言或直接聯絡作者
INTRODUCTION
根據2019年11月美國FDA釋出的Adaptive Designs for Clinical Trials of Drugs and Biologics –Guidance for Industry以及2021年1月國家藥監局藥審中心釋出的《藥物臨床試驗適應性設計指導原則(試行)》 [1],適應性設計被明確地定義為:按照預先設定的計劃,在期中分析時使用試驗期間累積的資料對試驗作出相應修改的臨床試驗設計。
概括來說,適應性設計是按照“預先的計劃”,利用試驗中已經累積的真實資料,透過即時的“學習”,“適當”地修改試驗方案,以更好地適應當前的研究環境。適應性設計的一大原則是根據已有的計劃更好地改進已經在進行中的試驗,而不是對試驗過程中發現的因試驗設計缺陷而可能導致試驗失敗的臨時補救策略。
最早應用於臨床試驗的適應性設計被稱為成組序貫設計。該設計主要是按照方案預先的計劃,在試驗過程中進行1次或者多次期中分析,根據每次期中分析的結果對後續試驗作出決策。這些決策通常包括了:達成優效結果而提前終止試驗;達成無效性結果而提前對試驗無效終止;因為安全性不佳而提前終止試驗;繼續試驗。
在本設計中,大機率會涉及I類錯誤,也就是alpha的矯正+,以保證總I類錯誤被控制在事先設定的水平上(如0.05)。如果期中分析至少有一次優效性分析,且有提前終止試驗的可能,則應調整分析的 I 類錯誤率以將總 I 類錯誤率控制在事先設定的水平。調整 I 類錯誤率的常用方法包括 Pocock 方法、O'Brien & Fleming 方法和 Lan & DeMets 方法等。
本次主要介紹的適應性設計將主要考慮樣本量的變化,顧名思義叫做樣本量重新估計設計。它指的是依據預先設定的期中分析計劃,利用累積的試驗資料重新計算所需樣本量,以保證最終的統計檢驗可以達到預先設定的目標或修改後的(把握度)目標,並同時能夠控制I類錯誤率。
初始樣本量的估計通常取決於效應量、主要終點的變異度、試驗的入組/隨訪時間以及受試者脫落率等諸多因素,這些因素往往取決於既往的(同類/相似適應症)研究資料。多數情況下,試驗設計階段樣本量的估計所需要的引數資訊往往不夠充分,可能會導致樣本量估算的不夠準確。適應性設計中的樣本量重新估計為此類問題提供了有效的解決方案。
一 樣本量重新估計的分類
樣本量重新估計的方法可以分為盲態方法和非盲態方法。
盲態方法,也稱為非比較方法(non-comparative analysis),指的是在期中分析時,不使用實際試驗分組資訊,或者不做任何涉及組間比較的分析。
盲態下的樣本量重估是指利用累積的資料,重新計算在初始計算樣本量時涉及的重要引數(例如合併方差或合併事件發生率等),然後採用新得出的引數,對樣本量進行重新估計。這個重新估計的過程,不涉及試驗的實際治療分組,也不涉及組間(療效)比較,因此一般不需要考慮I類錯誤的校正。本盲態下的樣本量重估方法比較容易實施,一般不會引入操作偏倚,而且相關的統計方法也較為完善,只要再試驗設計的階段預先做好規劃。
非盲方法,也稱為比較分析方法(comparative analysis)。本方法是指在期中分析時使用了試驗分組資訊(包括各組的真實名稱或可區分的分組程式碼)的分析,並且分析內容涉及不同試驗組之間的比較。
非盲態下的樣本量重估需要預先在試驗方案中進行詳細描述,包括重新估計的時間點、決策時使用的標準、重新估計時使用的方法,調整I類錯誤α的方法、執行非盲態的人員,以及執行整個操作過程的人員等。應該注意的是,同一個試驗中,不宜做過多次數的樣本量重估;同時,如果重估後的樣本量小於一開始設計的樣本量時,通常不接受將樣本量向下調整,維持原本的樣本量繼續試驗。
二 非盲態樣本量重新估計的考慮
是否採用非盲態樣本量重估需要考慮諸多問題,例如:如果前期資料比較成熟可靠,是否真的有必要進行非盲態下的樣本重估?又或者,進行非盲態下的樣本量重估一般需要第三方IDMC團隊進行支援,會消耗較多的時間和人力,如果研究本身入組較快,期中分析完成後是否還有足夠的時間對試驗的樣本量進行調整等等。
除以上以及非盲狀態下進行期中分析需要核心考慮的I類錯誤校正的問題外,非盲狀態下的樣本量重估實際運用時,一般會在期中分析結果落到某一個範圍內時(可設定多個範圍),進行固定比例的樣本量調整,以此來降低根據期中分析結果範圍組間療效實際差異而帶來的破盲風險(如透過樣本量倒推效應量等)。
三 非盲態樣本量重估的方法簡介
4.1 CHW法

4.2 Promising Zone希望區間法


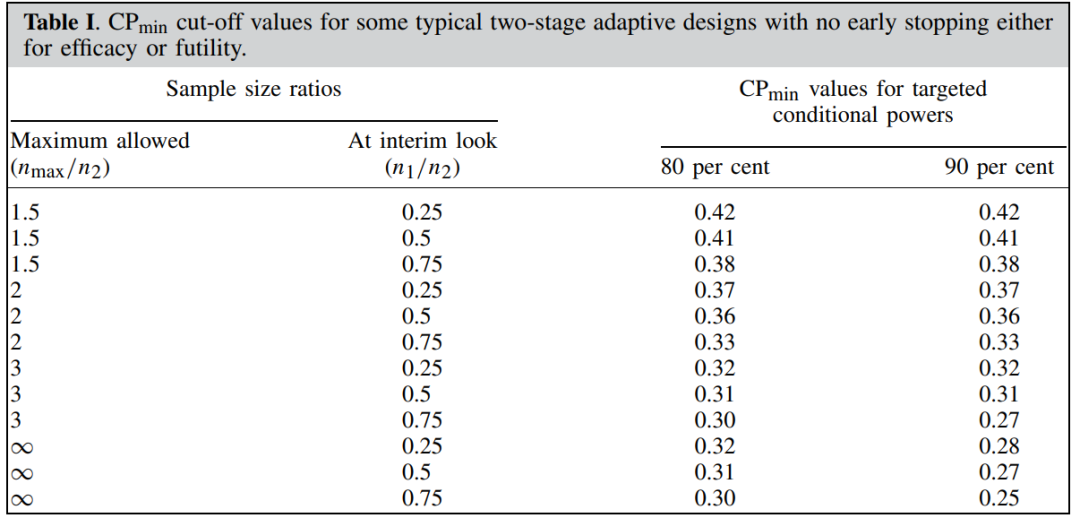
圖1 CPmin取值
總結
透過以上對兩種非盲態樣本量重估的方法(CHW法和希望區間法)的簡介,我們可以看出,在前期做好計劃的前提下,進行樣本量重估,可以在不消耗I類錯誤的情況下,合理地利用資源,保證試驗的把握度。因此,樣本量重估在確證性臨床試驗中被應用的越來越多。
但是,研究人員也應該警惕隨意使用或者不規範使用樣本量重估並結合適應性設計可能帶來的風險,不能一味地追求新方法,而是應該結合臨床實踐,對問題進行具體分析,以此來選定比如是否成組序貫的固定樣本量設計更為適合。
參考文獻
[1] 《藥物臨床試驗適應性設計指導原則(試行)》, 2021
[2] Cui L, Hung HM, Wang SJ. Modification of sample size in group sequential clinical trials. Biometrics 1999; 55:853--857.
[3] Mehta CR, Pocock SJ. Adaptive increase in sample size when interim results are promising: A practical guide with examples 2011; 30(28):3267-84
[4] Bauer P, Kohne K. Evaluation of experiments with adaptive interim analyses. Biometrics 1994; 50:1029—104
完結
原文連結:https://mp.weixin.qq.com/s/jN1wCVhwofImlMOapWiHbQ












0則評論