開篇宣告:1:以下內容轉自以下內容轉自微信公眾號新藥說《BMS臨床III期失敗》,如有侵權,可聯絡刪除
2. 以下觀點,僅代表作者個人觀點,請帶著質疑的態度去閱讀。如有問題,歡迎評論區留言或直接聯絡作者
BMS臨床III期失敗
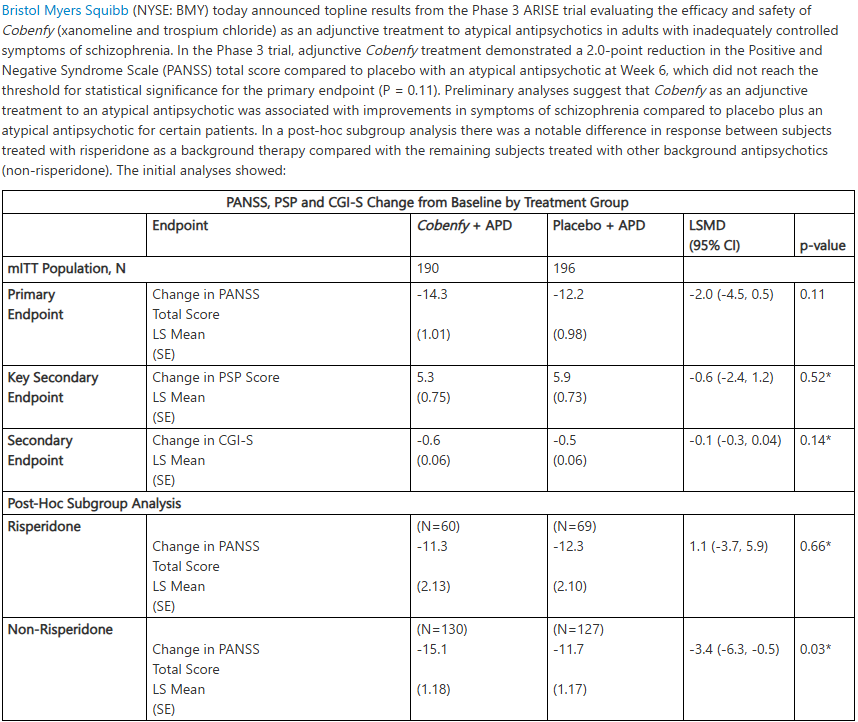
4月22日,百時美施貴寶釋出了Cobenfy(xanomeline和trospium chloride)作為非典型抗精神病藥物輔助療法治療成人精神分裂症的III期ARISE試驗的頂線結果。儘管該試驗在第6周時PANSS總評分顯示出2.0分的降低,但未達到主要終點的統計學意義。
這項為期6周的隨機、雙盲、安慰劑對照、多中心、門診研究納入了對現有抗精神病藥物反應不足的成年精神分裂症患者。研究的主要目標是透過陽性和陰性症狀量表 (PANSS) 總分 相對於基線的變化來評估Cobenfy作為輔助治療的療效。
初步結果顯示,與安慰劑加非典型抗精神病藥物組相比,接受Cobenfy加非典型抗精神病藥物治療的患者在第6周時PANSS總分降低了2.0分。然而,這一差異並未達到主要終點所需的統計學顯著性。
儘管主要終點未達到統計學顯著性,但初步分析表明,對於某些患者而言,與安慰劑組相比,Cobenfy作為輔助治療與精神分裂症症狀的改善相關。尤其值得關注的是一項事後亞組分析顯示,接受利培酮 (risperidone)作為背景治療的患者與接受其他背景抗精神病藥物(非利培酮類,包括帕利哌酮、阿立哌唑、齊拉西酮、魯拉西酮和卡利拉嗪)治療的患者之間存在顯著的反應差異。在非利培酮亞組中,Cobenfy組的PANSS總分變化具有統計學意義 (p=0.03),顯示出-3.4分的差異。
除了PANSS總分外,該試驗還評估了包括個人與社會功能 (PSP) 量表和臨床總體印象嚴重度 (CGI-S) 量表在內的多個次要終點。初步分析顯示,在這些次要終點上,Cobenfy 組與安慰劑組之間沒有觀察到統計學上的顯著差異。
Cobenfy 作為輔助治療的安全性與耐受性與之前的單藥治療試驗結果一致。BMS表示將進行進一步的資料分析,並計劃與監管機構討論潛在的後續步驟。 目前正在針對包括阿爾茨海默病和自閉症譜系障礙相關症狀、雙相情感障礙等多種神經精神疾病推進 Cobenfy 的臨床開發專案。
Cobenfy (xanomeline 和 trospium chloride),曾用名KarXT,是一種口服藥物,被批准用於治療成人精神分裂症。它結合了xanomeline(一種優先結合 M1 和 M4 型毒蕈鹼受體雙重激動劑)和trospium chloride(一種主要在周圍組織發揮作用而不易穿過血腦屏障的毒蕈鹼受體拮抗劑)。Cobenfy的確切作用機制尚不完全清楚,但其療效被認為與 xanomeline 在中樞神經系統 M1 和 M4 型毒蕈鹼乙醯膽鹼受體上的激動活性有關。
完結











0則評論