開篇宣告:1:以下內容轉自以下內容轉自微信公眾號CMAC釋出《夏結來教授談“CFDI臨床試驗資料管理和統計分析覈查要點”,FDA看了都說穩~》,如有侵權,可聯絡刪除
2. 以下觀點,僅代表作者個人觀點,請帶著質疑的態度去閱讀。如有問題,歡迎評論區留言或直接聯絡作者
夏結來教授談“CFDI臨床試驗資料管理和統計分析覈查要點”,FDA看了都說穩~
編者按
西安空軍軍醫大學教授夏結來於2025年3月18-20日參加蘇州國際博覽中心舉行的2025 CMAC年會。在“全球同步與出海落地篇:與全球同步、與未來同行”板塊,“國際遞交臨床試驗監管覈查的要求與實戰分享”分論壇,作為一名資深的臨床研究與統計從業者,他依據已經完成的國家藥品監督管理局食品藥品稽覈查驗中心(CFDI)委託研究課題,深度解析了CFDI對於臨床試驗資料管理和統計覈查要點,先培訓,再規範,後覈查。這裏略作修改後,加以發表。
以下為夏結來教授演講的文章全文:
一 課題概況
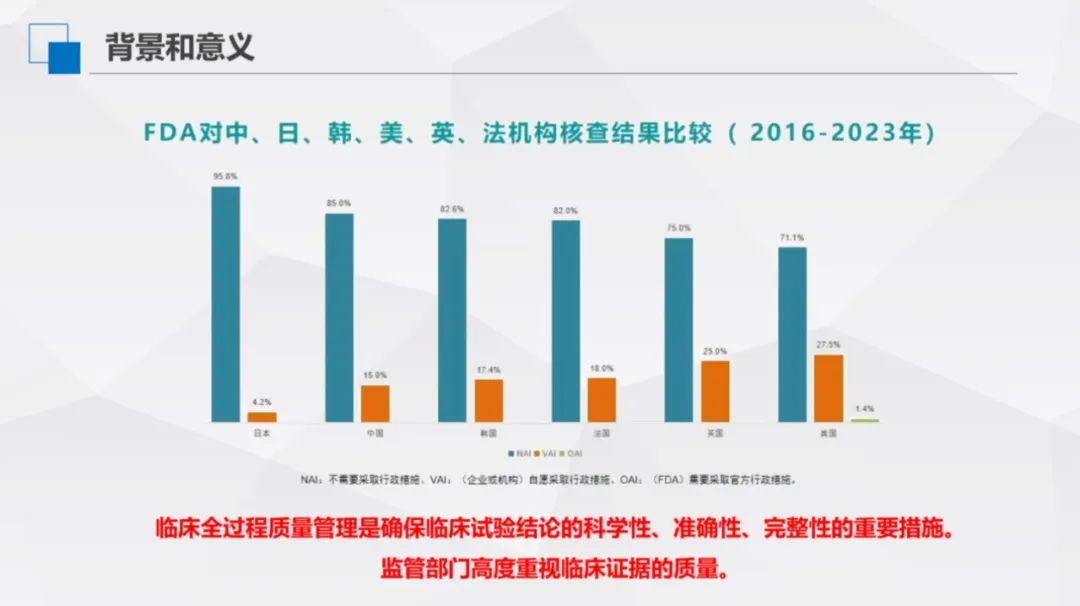
圖1
伴隨國內監管工作推進及行業對臨床試驗認知加深,中國臨床試驗資料質量顯著提升,逐步向國際先進醫藥研發國家靠攏,既彰顯臨床試驗管理的積極成果,也再次印證強化臨床質量管理、築牢資料可靠性的重要意義。
2016-2023 年,FDA對中、日、韓、美、英、法等國機構展開覈查,覈查結果體現了全過程質量管理在臨床試驗中的關鍵作用,反映出監管部門對臨床證據質量的高度重視,也使得臨床試驗結論科學性、準確性、完整性得到了空前的提升。覈查結果分為三類,即NAI:不需要採取行政措施;VAI:(企業或者機構)自願採取行政措施;OAI:(FDA)需要採取官方行政措施,僅美國佔 1.4%,其餘國家該時段無記錄。
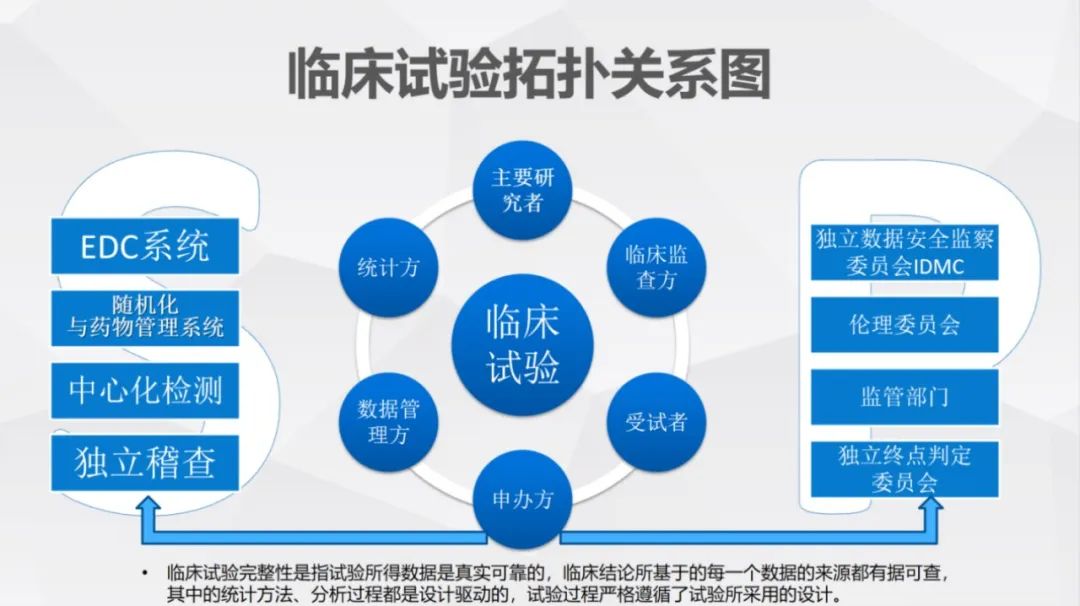
圖2
其中,臨床試驗完整性是指試驗所得資料是真實可靠的,臨床結論所基於的每一個數據的來源都有據可查,其中的統計方法、分析過程都是設計驅動的,試驗過程嚴格遵循了試驗所採用的設計。需要以臨床試驗為核心的主要研究者、臨床監查方、受試者、申辦方、資料管理方、統計方,共同進行精細管理,既確保資料真實,又規範流程。
在此背景之下,爲了確保真實性,CFDI承擔了大量的基於不同任務目的的現場覈查事務。爲了進一步提高覈查效力,做到有的放矢,進一步規範指導覈查行動,有必要對臨床試驗的不同環節制定相應的核查要點和核查手冊。爲了滿足臨床試驗質量評價與資料管理和統計分析具體環節覈查的新需求,我們承接了CFDI指令性課題。課題組成立兩個研究小組,從資料管理和統計分析兩部分分別進行研究,圍繞完整性與科學性兩方面要求針對重點環節一一形成核查要點和關注內容。經過兩年多的努力,《藥物臨床試驗資料管理和統計分析檢查員手冊》已編撰完成,並以結題報告的形式提交了CFDI。
二 課題開展情況、研究結果
1.資料管理組
圖3
資料管理課題小組開展了1次線下分工和框架討論,並透過6次線上討論和兩輪意見徵集,明確了質量評價和核查的要點,並建立了系統的目錄結構。確定了一級目錄4條,涵蓋準備階段、進行階段、結束階段、資料管理體系-延伸覈查;二級目錄14條,進一步細化各階段的核查內容;三級覈查要點122條,均明確了相應的風險等級。
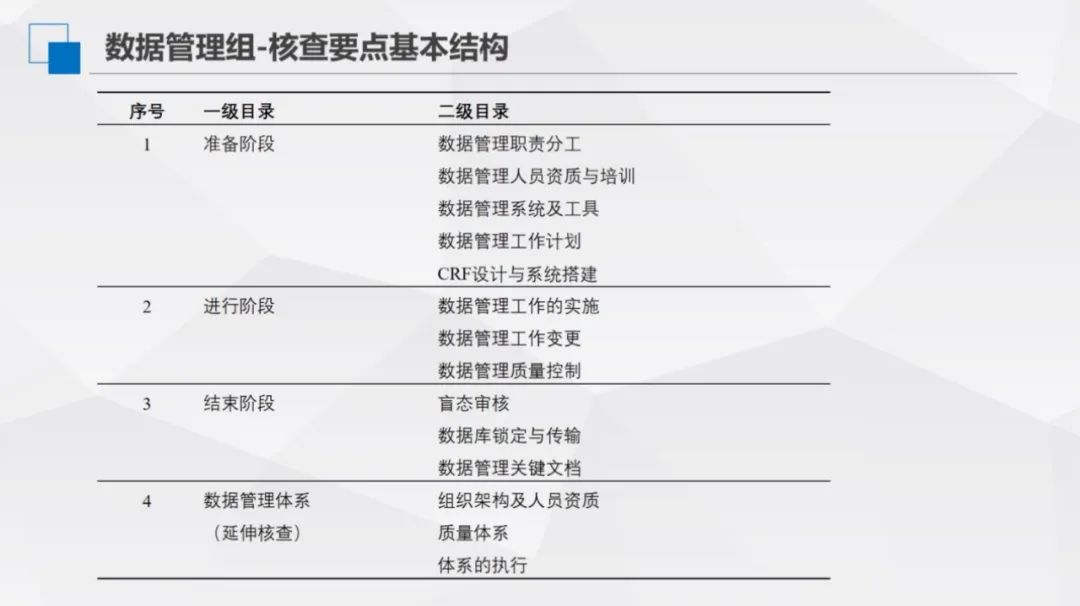
圖4
(1)準備階段:明確資料管理職責分工,覈查人員資質證明、培訓記錄,確認資料管理系統及工具合法使用,審查資料管理工作計劃制定情況,以及CRF設計與系統搭建的規範性,為資料管理奠定基礎。
(2)進行階段:聚焦資料管理工作實施,包括工作變更記錄與質量控制。覈查實施流程規範性、變更合理性及質量控制有效性,確保資料管理過程符合要求。
(3)結束階段:開展盲態稽覈,要求留存稽覈過程記錄,規範資料庫鎖定與傳輸操作,覈查資料管理關鍵文件完整性。記錄是工作執行的重要證明,無記錄則難以佐證工作落實。
(4)資料管理體系(延伸覈查):延伸覈查組織架構、人員資質、質量體系建設及執行情況。若前期覈查發現問題,將深入審查質量管理體系,判斷其是否流於形式。若在此階段覈查出現問題,直接與專案管理體系相關聯。此舉不僅是覈查手段,更旨在推動建立高質量資料管理隊伍,明晰崗位責任,從體系層面保障資料管理規範性,避免因體系漏洞引發對整體資料管理的質疑,實現“以查促建”,提升資料管理最終成果質量。
本研究共制定了4個基本維度,共計122個核查要點。根據臨床試驗資料管理中的風險點、後果嚴重程度及現場覈查的可操作性,指定了15個關鍵要點三級目錄。
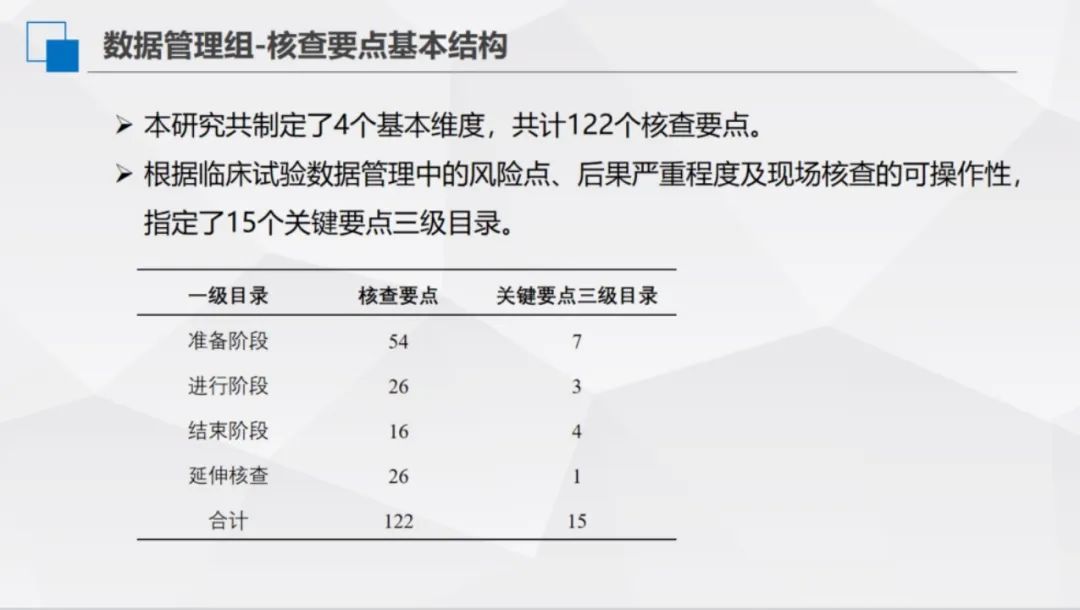
圖5
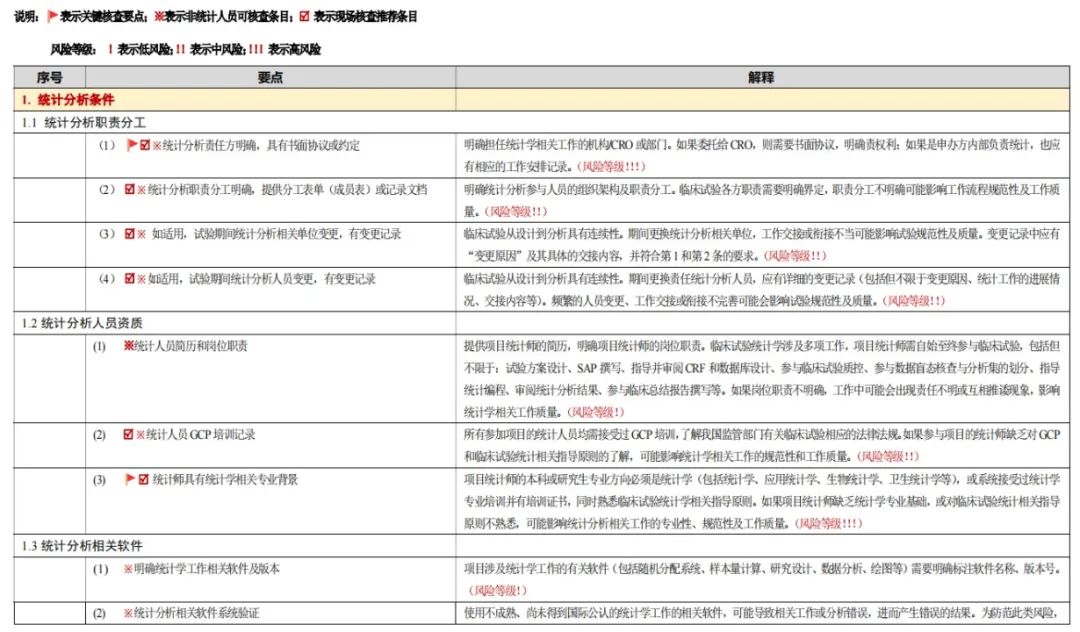
2.統計分析組
圖6
統計分析課題小組採用線上線下結合的工作模式推進研究。線上透過6次討論,確定一級目錄6條(含統計分析條件、統計學設計、統計學執行、統計分析必備文件、特殊覈查要點、延伸覈查)、二級目錄25條、三級目錄123條,明確技術要點與現場覈查要點,保留不適用於現場覈查的統計專屬考量部分,並面向泰格、復星、康特瑞科、齊魯等企業內部統計師收集首輪意見。
線下於2023年9月24日召開統計覈查要點定稿會,經討論徵集意見,最終界定關鍵覈查要點14條、現場覈查推薦條目82條、非統計人員可覈查條目88條,劃分風險等級(低、中、高風險)。2023年10月針對123條覈查要點形成解釋文件,經意見徵求,於12月10日小組總結會正式定稿。該模式融合線上討論的高效性與線下會議的深入性,確保統計分析覈查體系的科學性、規範性,推動課題工作有序完成。

圖7
(1)統計分析條件:覈查職責分工、人員資質及相關軟體使用;
(2)統計學設計:涵蓋估計目標、Ⅰ/Ⅱ類錯誤控制、樣本量估計、分析方法、敏感性分析的設計;
(3)統計學執行:涉及SAP制定、隨機化和盲法、分析人群劃分、程式設計及結果報告等環節;
(4)統計分析必備文件:包含分析相關文件、隨機化盲法文件IDMC文件、特殊文件等;
(5)特殊覈查要點:針對開放試驗、單臂設計、期中分析、適應性設計等特殊場景;
(6)延伸覈查:關注SOP及版本控制、人員管理、系統驗證等延伸內容,確保統計分析全流程規範。
本研究共制定了6個基本維度,共計122個核查要點。根據臨床試驗統計分析中的風險點、後果嚴重程度及現場覈查的可操作性,指定了36條關鍵要點和83條現場覈查推薦條目。
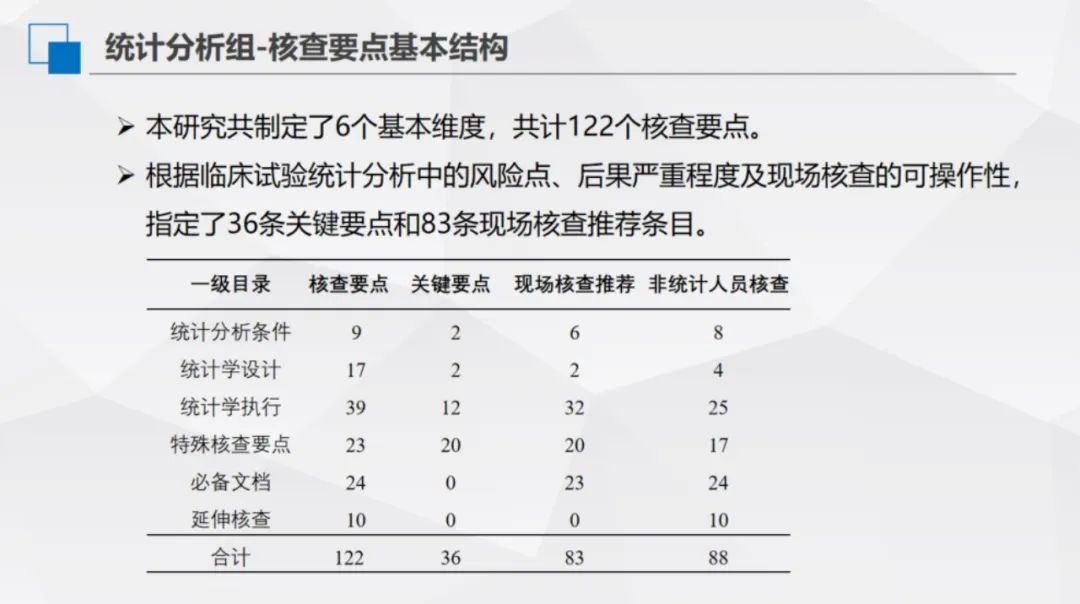
圖8
統計分析組覈查側重點圍繞五大共性問題展開。
第一,SAP制定。需由試驗統計學專業人員起草,確保與統計分析內容一致,重點關注資料驅動的計劃變更。
第二,隨機化及盲法。評估執行不規範引發的試驗結果偏倚,關注變更7對試驗完整性、Ⅰ類錯誤率、統計分析及結果解讀等各方面的影響。
第三,分析人群劃分。強調統計師參與,關注資料驅動的劃分導致假陽性錯誤率的增加。
第四,結果報告。強調結果的可重現,與統計分析計劃的一致,避免有選擇性的報告,關注不恰當的事後修改或增刪引入偏倚。
第五,IDMC。強化期中分析規範執行,關注不規範的操作對試驗完整性和科學性的破壞。
三 總結與展望、成果展示
1.總結與展望
本研究透過專家座談、分組討論、意見徵集等形式,制定了適用於我國藥物臨床試驗資料管理和統計分析工作的現場覈查要點並形成檢查員手冊,既具有科學性,又滿足合規性要求。
從內容上看,既包括現場覈查需要檢查的內容,又規定進一步對質量體系的核查內容。故本覈查要點既能用於指導覈查員開展現場覈查工作的要求,又可用於申辦方、合同研究機構、研究者自查,以便進一步提高臨床研究的質量,並不斷改進自身的質量管理體系。
未來將根據實際工作中的反饋,對本要點作進一步的完善;同時課題組將積極與行業協會合作,將本要點打造成行業標準,以期不斷提高我國藥物臨床試驗資料管理和統計分析工作的水平和質量,形成監管部門、學術界及工業界合作的正規化。
2.成果展示
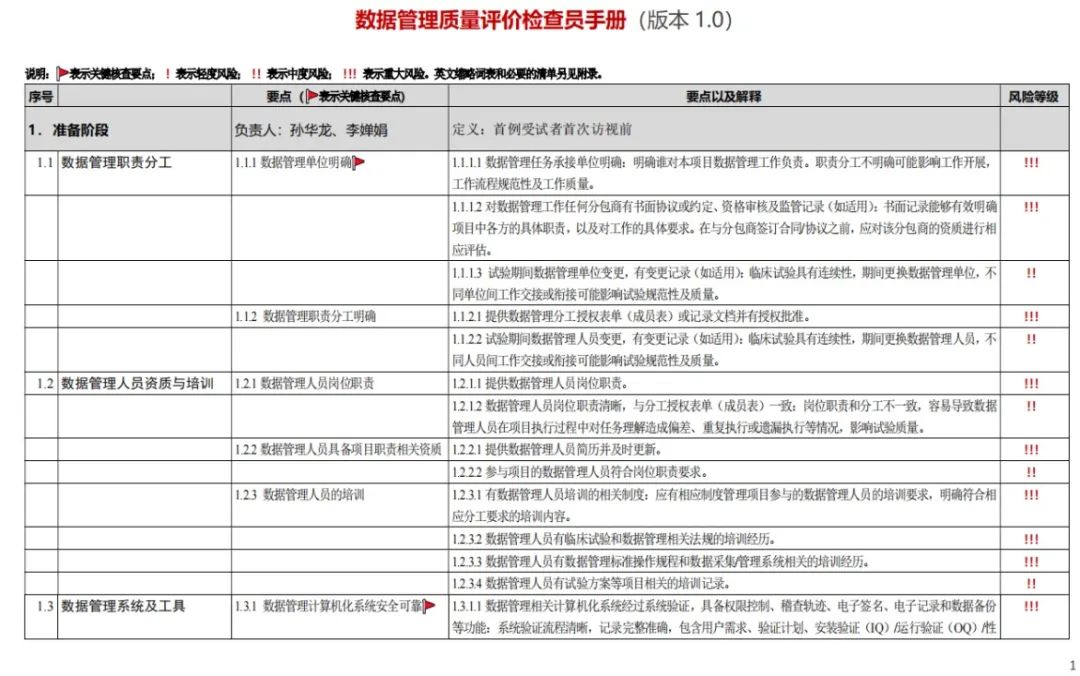
資料管理質量評價檢查員手冊(V1.0)
統計分析質量評價檢查員手冊(V1.0)
作者簡介

博士生導師,國家藥品管理局資深統計學審評諮詢專家。
現任CSCO生物統計學專家委員會主任委員、歷任中國資訊協會統計理論與方法專業委員會副主任委員、中華預防醫學會生物統計學分會侯任主任委員、中國衛生統計雜誌編委、中國臨床試驗統計學組副組長、中國臨床試驗資料管理學組組長。
先後獲8項國家自然科學基金資助,與國家藥品審評中心聯合申報十三五重大科技專項1項。獲國家科技進步二等獎2項、軍隊科技進步一、二等獎各1項。提出了迴歸係數根方估計和廣義根方估計新方法。
先後在在Statistics in Medicine, The New England Journal of Medicine等SCI收錄的期刊上以共同第一作者或通訊作者發表論文40餘篇。
設計:李陽
編輯:李傑
稽覈:夏結來
本文整理自:【中國(蘇州)創新藥物醫學大會暨2025CMAC年會“國際遞交臨床試驗監管覈查的要求與實戰分享”分論壇】
完結











0則評論