开篇声明:1:以下内容转自以下内容转自微信公众号凯诺医药《【技术】非盲态下的样本量重估》,如有侵权,可联系删除
2. 以下观点,仅代表作者个人观点,请带着质疑的态度去阅读。如有问题,欢迎评论区留言或直接联系作者
INTRODUCTION
根据2019年11月美国FDA发布的Adaptive Designs for Clinical Trials of Drugs and Biologics –Guidance for Industry以及2021年1月国家药监局药审中心发布的《药物临床试验适应性设计指导原则(试行)》 [1],适应性设计被明确地定义为:按照预先设定的计划,在期中分析时使用试验期间累积的数据对试验作出相应修改的临床试验设计。
概括来说,适应性设计是按照“预先的计划”,利用试验中已经累积的真实数据,通过即时的“学习”,“适当”地修改试验方案,以更好地适应当前的研究环境。适应性设计的一大原则是根据已有的计划更好地改进已经在进行中的试验,而不是对试验过程中发现的因试验设计缺陷而可能导致试验失败的临时补救策略。
最早应用于临床试验的适应性设计被称为成组序贯设计。该设计主要是按照方案预先的计划,在试验过程中进行1次或者多次期中分析,根据每次期中分析的结果对后续试验作出决策。这些决策通常包括了:达成优效结果而提前终止试验;达成无效性结果而提前对试验无效终止;因为安全性不佳而提前终止试验;继续试验。
在本设计中,大概率会涉及I类错误,也就是alpha的矫正+,以保证总I类错误被控制在事先设定的水平上(如0.05)。如果期中分析至少有一次优效性分析,且有提前终止试验的可能,则应调整分析的 I 类错误率以将总 I 类错误率控制在事先设定的水平。调整 I 类错误率的常用方法包括 Pocock 方法、O'Brien & Fleming 方法和 Lan & DeMets 方法等。
本次主要介绍的适应性设计将主要考虑样本量的变化,顾名思义叫做样本量重新估计设计。它指的是依据预先设定的期中分析计划,利用累积的试验数据重新计算所需样本量,以保证最终的统计检验可以达到预先设定的目标或修改后的(把握度)目标,并同时能够控制I类错误率。
初始样本量的估计通常取决于效应量、主要终点的变异度、试验的入组/随访时间以及受试者脱落率等诸多因素,这些因素往往取决于既往的(同类/相似适应症)研究数据。多数情况下,试验设计阶段样本量的估计所需要的参数信息往往不够充分,可能会导致样本量估算的不够准确。适应性设计中的样本量重新估计为此类问题提供了有效的解决方案。
一 样本量重新估计的分类
样本量重新估计的方法可以分为盲态方法和非盲态方法。
盲态方法,也称为非比较方法(non-comparative analysis),指的是在期中分析时,不使用实际试验分组信息,或者不做任何涉及组间比较的分析。
盲态下的样本量重估是指利用累积的数据,重新计算在初始计算样本量时涉及的重要参数(例如合并方差或合并事件发生率等),然后采用新得出的参数,对样本量进行重新估计。这个重新估计的过程,不涉及试验的实际治疗分组,也不涉及组间(疗效)比较,因此一般不需要考虑I类错误的校正。本盲态下的样本量重估方法比较容易实施,一般不会引入操作偏倚,而且相关的统计方法也较为完善,只要再试验设计的阶段预先做好规划。
非盲方法,也称为比较分析方法(comparative analysis)。本方法是指在期中分析时使用了试验分组信息(包括各组的真实名称或可区分的分组代码)的分析,并且分析内容涉及不同试验组之间的比较。
非盲态下的样本量重估需要预先在试验方案中进行详细描述,包括重新估计的时间点、决策时使用的标准、重新估计时使用的方法,调整I类错误α的方法、执行非盲态的人员,以及执行整个操作过程的人员等。应该注意的是,同一个试验中,不宜做过多次数的样本量重估;同时,如果重估后的样本量小于一开始设计的样本量时,通常不接受将样本量向下调整,维持原本的样本量继续试验。
二 非盲态样本量重新估计的考虑
是否采用非盲态样本量重估需要考虑诸多问题,例如:如果前期数据比较成熟可靠,是否真的有必要进行非盲态下的样本重估?又或者,进行非盲态下的样本量重估一般需要第三方IDMC团队进行支持,会消耗较多的时间和人力,如果研究本身入组较快,期中分析完成后是否还有足够的时间对试验的样本量进行调整等等。
除以上以及非盲状态下进行期中分析需要核心考虑的I类错误校正的问题外,非盲状态下的样本量重估实际运用时,一般会在期中分析结果落到某一个范围内时(可设置多个范围),进行固定比例的样本量调整,以此来降低根据期中分析结果范围组间疗效实际差异而带来的破盲风险(如通过样本量倒推效应量等)。
三 非盲态样本量重估的方法简介
4.1 CHW法

4.2 Promising Zone希望区间法


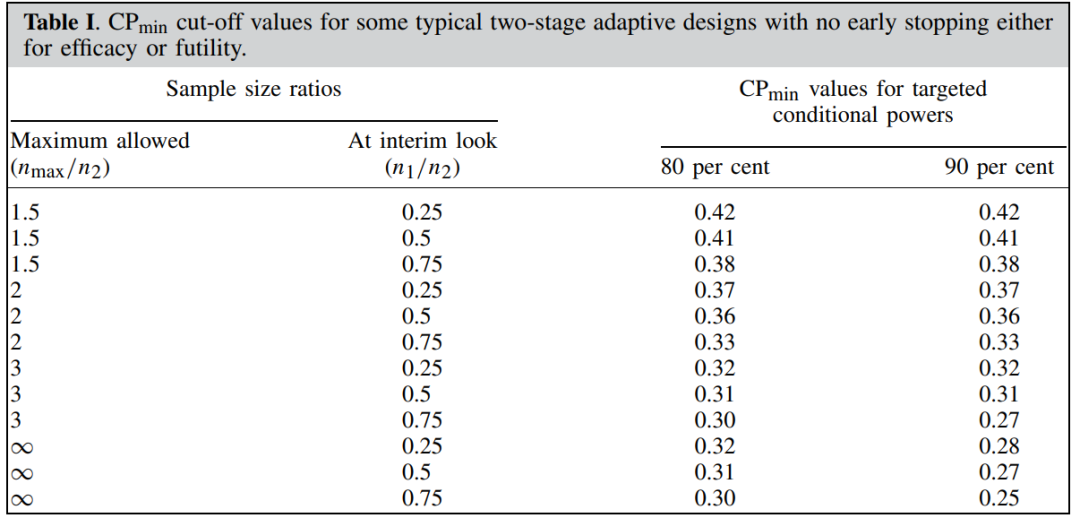
图1 CPmin取值
总结
通过以上对两种非盲态样本量重估的方法(CHW法和希望区间法)的简介,我们可以看出,在前期做好计划的前提下,进行样本量重估,可以在不消耗I类错误的情况下,合理地利用资源,保证试验的把握度。因此,样本量重估在确证性临床试验中被应用的越来越多。
但是,研究人员也应该警惕随意使用或者不规范使用样本量重估并结合适应性设计可能带来的风险,不能一味地追求新方法,而是应该结合临床实践,对问题进行具体分析,以此来选定比如是否成组序贯的固定样本量设计更为适合。
参考文献
[1] 《药物临床试验适应性设计指导原则(试行)》, 2021
[2] Cui L, Hung HM, Wang SJ. Modification of sample size in group sequential clinical trials. Biometrics 1999; 55:853--857.
[3] Mehta CR, Pocock SJ. Adaptive increase in sample size when interim results are promising: A practical guide with examples 2011; 30(28):3267-84
[4] Bauer P, Kohne K. Evaluation of experiments with adaptive interim analyses. Biometrics 1994; 50:1029—104
完结
原文链接:https://mp.weixin.qq.com/s/jN1wCVhwofImlMOapWiHbQ












0条评论